کلرید کبالت (II) یک ترکیب معدنی از کبالت و کلر با فرمول CoCl است. این ترکیب چندین هیدرات CoCl را تشکیل می دهد. کلرید کبالت بدون آب این ماده یک جامد کریستالی آبی رنگ است. و اشکال کلرید کبالت دی هیدرات بنفش و هگزاهیدرات آن صورتی رنگ است. نمونه های تجاری معمولاً هگزاهیدرات هستند که یکی از رایج ترین ترکیبات کبالت در آزمایشگاه است. میتوانید در بخش مقالات علمی فروشگاه مسترآزما سایر مقالات علمی مرتبط را مطالعه کنید.
ویژگی های کلرید کبالت در اشکال مختلف
کلرید کبالت بدون آب

در دمای اتاق، کلرید کبالت بی آب دارای ساختار کلرید کادمیوم است. ( CdCl2) (R 3 m) که در آن یون های کبالت (II) به صورت هشت وجهی هماهنگ شده اند. در حدود 706 درجه سانتیگراد (20 درجه زیر نقطه ذوب)، اعتقاد بر این است که هماهنگی به چهار وجهی تغییر می کند. فشار بخار 7.6 میلی متر جیوه در نقطه ذوب گزارش شده است.
کلرید کبالت نسبتاً در آب محلول است. تحت فشار اتمسفر، غلظت جرمی محلول اشباع CoCl2 در آب حدود 54٪ در نقطه جوش، 120.2 درجه سانتیگراد است. 48% در 51.25 درجه سانتیگراد؛ 35٪ در 25 درجه سانتیگراد؛ 33٪ در 0 درجه سانتیگراد؛ و 29٪ در -27.8 درجه سانتیگراد.
محلول های آبی رقیق شده CoCl2 حاوی گونه [Co(H2O)6]2+علاوه بر یون های کلرید . محلول های غلیظ در دمای اتاق قرمز هستند اما در دمای بالاتر آبی می شوند.
کلرید کبالت هگزاهیدرات و دی هیدرات
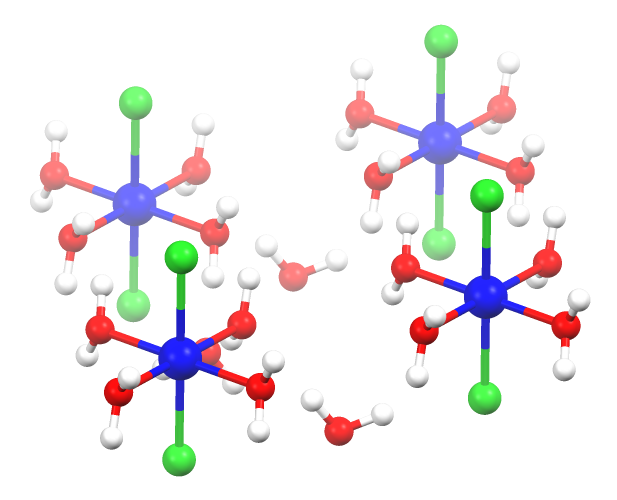
واحد کریستالی هگزا هیدرات جامد CoCl2•6 H2O حاوی مولکول خنثی ترانس – CoCl است. 2(H2O)4 و دو مولکول آب تبلور . این گونه به راحتی در آب و الکل حل می شود.
کلرید کبالت بدون آب، رطوبت سنجی و هگزاهیدرات رقیق کننده است . دی هیدرات، CoCl2 (H2O)2 ، یک پلیمر هماهنگی است . هر مرکز Co با چهار لیگاند کلرید مضاعف هماهنگ شده است . هشت وجهی توسط یک جفت لیگاند آبی متقابل تکمیل می شود .
تهیه و ماده سازی کلرید کبالت
کلرید کبالت را می توان در محلول آبی از هیدروکسید کبالت (II) یا کربنات کبالت (II) و اسید هیدروکلریک تهیه کرد.
CoCO3 + 2 HCl(aq) → CoCl2(aq) + CO2 + H2O Co(OH)2 + 2 HCl(aq) → CoCl2(aq) + 2H2O
کلرید کبالت دی هیدرات جامد و هگزاهیدرات را می توان از طریق تبخیر به دست آورد. با خنک کردن محلول های آبی اشباع، دی هیدرات بین 120.2 درجه سانتیگراد تا 51.25 درجه سانتیگراد و هگزا هیدرات زیر 51.25 درجه سانتیگراد تولید می شود. یخ آب، به جای کلرید کبالت، از محلول هایی با غلظت کمتر از 29 درصد متبلور می شود. فرم های مونوهیدرات و بی آب را می توان با خنک کردن محلول ها فقط تحت فشار بالا، به ترتیب بالای 206 درجه سانتی گراد و 335 درجه سانتی گراد به دست آورد.
ترکیب کلرید کبالت بی آب را می توان با حرارت دادن هیدرات ها تهیه کرد.
در حرارت دادن سریع یا در یک ظرف دربسته، هر یک از هیدرات های 6، 2 و 1 تا حدی به مخلوط هیدرات پایین بعدی و محلول اشباع در دمای 51.25 درجه سانتی گراد، 206 درجه سانتی گراد و 335 درجه سانتی گراد ذوب می شوند. به ترتیب. با حرارت دادن آهسته در یک ظرف باز، به طوری که فشار بخار آب روی جامد عملاً صفر باشد. آب از هر یک از هیدرات های جامد 6-، 2- و 1- تبخیر می شود و هیدرات پایین بعدی باقی می ماند. حدود 40 درجه سانتیگراد، 89 درجه سانتیگراد و 125 درجه سانتیگراد به ترتیب. اگر فشار جزئی بخار آب با جامد در تعادل باشد. مانند یک محفظه محدود اما تحت فشار، تجزیه به ترتیب در حدود 115 درجه سانتیگراد، 145 درجه سانتیگراد و 195 درجه سانتیگراد رخ می دهد.
کم آبی را می توان با تری متیل سیلیل کلراید نیز انجام داد :
CoCl 2•6H 2O + 12 (CH 3) 3SiCl → CoCl 2 + 6[(CH 3) 3SiCl] 2O + 12 HCl
ترکیب بی آب را می توان با تصعید در خلاء خالص کرد.
واکنش کلرید کبالت در آزمایشگاه
در آزمایشگاه، کلرید کبالت (II) به عنوان یک پیش ساز رایج برای سایر ترکیبات کبالت عمل می کند. به طور کلی، محلول های آبی رقیق شده نمک مانند سایر نمک های کبالت (II) رفتار می کنند، زیرا این محلول ها از [Co(H2O)6]2+ تشکیل شده اند.
یون بدون توجه به آنیون به عنوان مثال، چنین محلول هایی پس از تصفیه با سولفید هیدروژن H رسوبی از سولفید کبالت CoS ایجاد می کنند. H2S
کلریدهای مجتمع
هگزا هیدرات و نمک بی آب اسیدهای لوئیس ضعیف هستند. مجرای افزایشی معمولاً یا هشت وجهی یا چهار وجهی هستند. این یک کمپلکس هشت وجهی با پیریدین (C5H5N) است:
CoCl 2·6H 2O + 4 C 5H 5N → CoCl 2(C 5H 5N) 4 + 6 H 2O
با تری فنیل فسفین (P(C6H5)3) یک کمپلکس چهار وجهی نتیجه می دهد:
CoCl 2·6H 2O + 2 P(C 6H 5) 3 → CoCl 2[P(C 6H 5) 3] 2 + 6 H 2O
نمک های کمپلکس آنیونی CoCl 4 2- را می توان با استفاده از کلرید تترا اتیل آمونیوم تهیه کرد:
CoCl 2 + 2 [(C2H5)4N] Cl → [(C2H5)4N)] 2 [CoCl4]
یون تتراکلبالتات [CoCl 4 ] 2- یون آبی است که با افزودن اسید کلریدریک به محلول های آبی کلرید کبالت هیدراته، که صورتی رنگ هستند، تشکیل می شود.
خاصیت رطوبت گیری
کلرید کبالت به دلیل تغییر رنگ متمایز آن هنگام هیدراته شدن، یک شاخص رایج رطوبت بصری است. تغییر رنگ از مقداری سایه آبی در هنگام خشک شدن به صورتی در صورت هیدراته شدن است. اگرچه سایه رنگ به زیرلایه و غلظت بستگی دارد. آن را به کاغذ آغشته می کنند تا نوارهای آزمایشی برای تشخیص رطوبت در محلول ها یا آهسته تر در هوا/گاز بسازند. خشککنندههایی مانند سیلیکاژل میتوانند کلرید کبالت را برای نشان دادن زمان مصرف (یعنی هیدراته) ترکیب کنند.
کاربردهای کلرید کبالت
- جوهر نامرئی : هنگامی که در محلول معلق می شود، کلرید کبالت (II) می تواند روی یک سطح نامرئی به نظر برسد. هنگامی که همان سطح متعاقباً در معرض گرمای قابل توجهی قرار می گیرد (مانند یک تفنگ گرمایی دستی یا فندک)، جوهر به طور دائم / غیرقابل برگشت به آبی تغییر می کند.
- کلرید کبالت یک القاکننده شیمیایی تثبیت شده پاسخ های هیپوکسی مانند مانند اریتروپوئزیس است. مکمل کبالت ممنوع نیست و بنابراین با آزمایش ضد دوپینگ فعلی تشخیص داده نمی شود. کلرید کبالت یک ماده ممنوعه در هیئت مسابقه نژادهای اصیل استرالیا است.
- کلرید کبالت یکی از روش هایی است که برای القای فشار خون شریانی ریوی در حیوانات برای تحقیق و ارزیابی اثربخشی درمان استفاده می شود.
فروش کلرید کبالت
مواد شیمیایی مورد نیاز خود را میتوانید از سایت مسترآزما mrazma.com سفارش دهید. فروشگاه مسترآزما عرضه کننده محصولات کمپانی های معتبر مرک merck , سیگما Sigma-Aldrich میباشد.
برای اطلاعات بیشتر از محصول روی آن کلیک کنید.
انتقادات و پیشنهادات کاربران گرامی
برای مطالعه سایر مقالات علمی و پزشکی به بخش مقالات وبسایت مستر آزما مراجعه نمایید.
در صورت نیاز به مطالعه مقاله ای خاص به کارشناسان ما اطلاع دهید تا مقاله را برای شما روی سایت قرار دهند.
نظرات خود را با ما به اشتراک بگذارید.

